2.1 อะตอมและโครงสร้างอะตอม
ส่วนที่เล็กที่สุดของธาตุซึ่งเข้าทําปฏิกิริยาเคมีได้ อะตอม ประกอบด้วยอนุภาคมูลฐานที่สําคัญ คือ นิวเคลียสเป็นแกนกลาง และมีอิเล็กตรอนเคลื่อนที่อยู่โดยรอบ, เดิมเรียกว่า ปรมาณู.
2.1.1 โครงสร้างอะตอม
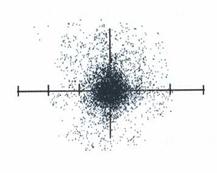
ดีโมครีตัส ( นักปราชญ์ชาวกรีก) ได้กล่าวว่าทุกสิ่งทุกอย่างประกอบขึ้นจาก อนุภาคที่เล็กมาก เล็กมากจนไม่สามารถมองเห็นได้ อนุภาคเล็กๆ เหล่านี้จะรวมพวกเข้าด้วยกันโดยวิธิการต่างๆ สำหรับอนุภาคเองนั้นไม่มีการเปลี่ยนแปลงและไม่สามารถจะแตกแยกออกเป็นชิ้นส่วนที่เล็กลงไปอีกได้ ดีโมครี- ตัสตั้งชื่ออนุภาคนี้ว่าอะตอม (Atom) จากภาษากรีกที่ว่า atoms ซึ่งมีความหมายว่า ไม่สามารถแบ่งแยกได้อีก ตามความคิดเห็นของเขา อะตอมเป็นชิ้นส่วนที่เล็กที่สุดของสสารที่สามารถจะคงอยู่ได้ภาพการแปรียบเทียบขนาดของอะตอม
2.1.2 ประโยชน์จากการเรียนเรื่องโครงสร้างอะตอม
1. ทราบสมบัติทางเคมีและสมบัติการเปล่งแสงของธาตุ
2. เราสามารถศึกษาแกแล็กซี่ (galaxy) ดวงดาวและดาวเคราะห์ต่างๆ โดยพิจารณาจากการศึกษาสเปกตรัมที่ได้จากดวงดาว
2.1.3แบบจำลองอะตอมของจอห์นดอลตันจอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมโดยอาศัยข้อมูลจากการทดลองที่พอจะศึกษาได้และนับว่าเป็นทฤษฎีแรกที่เกี่ยวกับอะตอมที่พอจะเชื่อถือได้ ซึ่งมีใจความดังนี้
- สารทุกชนิดประกอบด้วยอนุภาคขนาดเล็กที่สุดเรียกว่า “อะตอม”
- อะตอมจะไม่สามารถแบ่งแยกได้ และไม่สามารถสร้างขึ้นใหม่ได้
- อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกันทุกประการ
- อะตอมของธาตุต่างกันจะมีสมบัติต่างกัน
- ธาตุตั้งแต่สองชนิดขึ้นไปสามารถรวมตัวกันเกิดเป็นสารประกอบ โดยมีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย เช่น CO CO 2
จากทฤษฎีอะตอมของดาลตัน แบบจำลองอะตอมมีลักษณะดังรูป ลักษณะแบบจำลองอะตอมของดอลตัน( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4 ใช้ไม่ได้ในปัจจุบัน)
ลักษณะแบบจำลองอะตอมของดอลตัน( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4 ใช้ไม่ได้ในปัจจุบัน)
ข้อ 1. อะตอมไม่ใช่สิ่งที่เล็กที่สุด อะตอมยังประกอบด้วยอนุภาคอิเล็กตรอน, โปรตอน, นิวตรอน เป็นต้น
ข้อ 3 - 4 อะตอมของธาตุชนิดเดียวกันมีคุณสมบัติทางกายภาพไม่เหมือนกัน กล่าวคือมีมวลไม่เท่ากัน ซึ่งจะได้กล่าวต่อไป ในเรื่อง " ไอโซโทรป"2.1.4 แบบจำลองอะตอมของทอมสัน
- ทอมสัน ค้นพบ อิเล็กตรอน
- การทดลองของรอเบิร์ด แอนดรูส์ มิลลิแกน ได้ผลการทดลองว่า อิเล็กตรอนมีประจุไฟฟ้าเท่ากับ 1.60 x 10 -19 คูลอมบ์ และอิเล็กตรอนมีมวลเท่ากับ 9.11 x 10 -28 กรัม
- โกลด์สไตน์ ค้นพบ โปรตอน
จากผลการทดลองของทอมสัน โกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้นเขาจึงเสนอแบบจำลองอะตอมว่า
- อะตอมมีลักษณะเป็นทรงกลม
- อะตอมไม่ใช่สิ่งที่เล็กที่สุด แต่อะตอมจะประกอบด้วยอิเล็กตรอน และอนุภาคอื่นๆอีก
- อะตอมประกอบด้วยอนุภาคอิเล็กตรอนที่มีประจุเป็นลบ อนุภาคโปรตอนมีประจุเป็นบวก
- อะตอมจะมีโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ
- อะตอมเป็นกลางทางไฟฟ้า เพราะ มีจำนวนประจุบวกเท่ากับประจุลบ
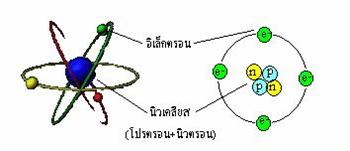
จากทฤษฎีอะตอมของทอมสัน แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของทอมสัน2.1.5 แบบจำลองอะตอมของรัทเทอร์ฟอร์ดอะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนาแน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ในอะตอมด้วย เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทปสรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้างจากทฤษฎีอะตอมของ รัทเทอร์ฟอร์ด แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของรัทเทอร์ฟอร์ด2.1.6 แบบจำลองอะตอมของนีลส์โบร์นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัวสเปกตรัม สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่างกันและมีความถี่ต่อเนื่องกันเป็นช่วงกว้างมีทั้งที่มองเห็นได้และมองเห็นไม่ได้มีชื่อเรียกต่างกันแสงที่ประสาทตาของมนุษย์สามารถรับรู้ได้เรียกว่าแสงที่ตามองเห็นมีความยาวคลื่นอยู่ในช่วง 400 ถึง 700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่างๆแต่ประสาทตาของมนุษย์ไม่สามารถแยกแสงที่มองเห็นเป็นสีต่างๆได้เองทำให้มองเห็นสีรวมกันซึ่งเรียกว่าแสงขาวและเมื่อแสงขาว ส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกันเรียกว่าแถบสเปกตรัมของแสงขาว
มักซ์ พลังค์ นักวิทยาศาสตร์ ชาวเยอรมันได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสำคัญระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวของคลื่นดังความสัมพันธ์ต่อไปนี้
E แปรผันตรงกับ v
หรือ E = hv
เนื่องจาก E = c/แลมดาร์
ดังนั้น E = hc/แลมดาร์ช
เมื่อ E คือพลังงานของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นจูล
h คือค่าคงตัวของพลังค์ มีค่า 6.626 × 10^-34 จูลต่อวินาที
v คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้า เท่ากับ 3 × 10^8 เมตรต่อวินาที
และ แลมดาร์ คือ ความยาวคลื่นมีหน่วยเป็นเมตร
ความสัมพันธ์ดังกล่าว เมื่อนำมาคำนวณพลังงานของแถบสีต่างๆในสเปกตรัมของแสงขาวซึ่งความยาวคลื่นต่างๆจะได้ดังนี้
จากการทดลองการใช้เกรตติงส่องดูแสงอาทิตย์และแสงจากหลอดฟลูออเรสเซนต์ สังเกตสิ่งที่ปรากฏแล้ว พบว่าสเปกตรัมจากแสงอาทิตย์มีสีต่อเนื่องกันเป็น แถบสเปกตรัม เส้นสเปกตรัมที่มองเห็นจากหลอดฟลูออเรสเซนต์ นอกจากจะมองเห็นเป็นแถบสเปกตรัมของสีชนิดต่างๆแล้วพื้นยังมีเส้นสีต่างๆปรากฏในแถบสเปกตรัมอีกด้วยและจากการสังเกตสเปกตรัมของไฮโดรเจนฮีเลียม นีออน และปรอท เพราะว่าถ้าแต่ละชนิดให้สเปกตรัมที่มีแสงสีต่างกันและมีจำนวน เส้นสีเฉพาะตัวเส้นสีนี้เรียกว่า เส้นสเปกตรัม
ธาตุต่างๆ เมื่อได้รับพลังงานจะเปล่งแสงเป็นสีต่างๆหลายสีเมื่อสีเหล่านั้นรวมกันแล้วจะสังเกตเห็นเป็นสีเดียวกันซึ่งทางเราไม่สามารถบอกความแตกต่างได้แต่เมื่อใช้แผ่นเกรตติงส่องดูจะเห็นเส้นสเปกตรัมของแต่ละธาตุที่มีลักษณะเฉพาะเช่นจำนวนสี จำนวนเส้น หรือตำแหน่งที่เกิดต่างกันไปการเกิดเส้นสเปกตรัมของธาตุอธิบายได้ว่าอิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบบริเวณนิวเคลียสมีพลังงานเฉพาะตัวที่ต่ำหรือกล่าวได้ว่าอะตอมอยู่ใน สถานะพื้น เมื่ออะตอมได้รับ พลังงานเพิ่มขึ้นทำให้อิเล็กตรอนถูกกระตุ้นให้มีพลังงานสูงขึ้นหรือ อะตอมอยู่ใน สถานะกระตุ้น ที่สถานะอะตอมจะไม่เสถียรเนื่องจากมีพลังงานสูงอิเล็กตรอนจึงคายพลังงานออกมาส่วนหนึ่งทำให้อะตอมมีพลังงานลดลงและกลับเข้าสู่สภาพที่มีพลังงานต่ำลงเพื่อให้อะตอมมีความเสถียรมากขึ้นพลังงานส่วนใหญ่ที่ขายออกมาจะปรากฏในรูปพลังงานแสงและสามารถคำนวณได้โดยใช้ความสัมพันธ์ตามสมการของพลังค์ ซึ่งได้กล่าวไว้แล้วในข้างต้นถ้าแสงสีเหล่านี้แยกออกจากกันอย่างชัดเจนจะปรากฏเป็นเส้นสเปกตรัมแต่ถ้าแสงสีที่ปรากฏออกมามีลักษณะต่อเนื่องกันเป็นเส้นเดียวอย่างกับรุ้งหรือจากไส้หลอดไฟฟ้า ซึ่งเป็นโลหะร้อนและมีอะตอมอยู่กันอย่างหนาแน่นจะให้สเปกตรัมเป็นแถบสเปกตรัมซึ่งยากแก่การวิเคราะห์และแปลผลต่อภาวะอิเล็กตรอนที่มีพลังงานต่างๆเรียกว่า ระดับพลังงานของอิเล็กตรอน การเปลี่ยนแปลงพลังงาน ของอิเล็กตรอนระหว่างสถานะการ์ตูนและสถานะพื้นสามารถ อุปมานได้กับการกลิ้งลงบันไดของลูกบอลจากรูปจะเห็นว่าพลังงานศักย์หน้าบันไดแต่ละท่านมีค่าไม่เท่ากันโดยลูกบอลที่อยู่บันไดขั้นต่ำจะมีพลังงานศักย์ต่ำกว่าบันไดขั้นสูงและผลต่างของพลังงานระหว่างบันได 2 ขั้นมีค่าเฉพาะตัวที่แน่นอนโดยบันไดที่อยู่ห่างกันมากๆจะมีผลต่างของพลังงานมากกว่าบันไดที่อยู่ติดกัน
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนทำให้สรุปได้ว่า
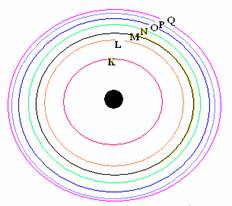
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,... ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ....จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของนีลส์โบร์2.1.7 แบบจำลองอะตอมแบบกลุ่มหมอกเป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้ แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2. กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน และระดับพลังงานอิเล็กตรอน3. กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน
 ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอกสรุปแบบจำลองอะตอม2.2 อนุภาคมูลฐานของอะตอมในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอกสรุปแบบจำลองอะตอม2.2 อนุภาคมูลฐานของอะตอมในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้าดังรูป
เมื่อไรน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้นทำให้ละอองน้ำมันบังหมดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวกบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าล็อคและปลดลอยนิ่งอยู่ระหว่างสนามไฟฟ้าขนาดของหยดน้ำมันที่ลอยนิ่งอยู่ระหว่างสนามไฟฟ้าสามารถสังเกตได้จากกล้องจุลทรรศน์และนำมาคำนวณหามวลของหยดน้ำมันที่สร้างความหนาแน่นของน้ำมันและจากความสำคัญของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้าทำให้สามารถคำนวณค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าค่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่ากับ 1.60 × 10^-19 คูลอมบ์ มิลลิแกนจึงสรุปว่าประจุของอิเล็กตรอนมีค่าเท่ากับ 1.60 × 10^-19 คูลอมบ์ ไม่นำมาใช้คำนวณร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้หมดอิเล็กตรอนเท่ากับ 9.11 × 10^-28 กรัม
ในปีพศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ออยเกนโกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีเอกซ์มีค่าประจุต่อมวลไม่คงที่จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัฐศาสตร์และทอมสันได้ทำการศึกษาหล่อในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจนทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากับอิเล็กตรอนและหาค่ามวลของประจุได้เป็น 1.673 × 10^-24 กรัมซึ่งมากกว่ามวลอิเล็กตรอนประมาณ 1840 เท่าที่อนุภาคนี้ว่าโปรตอน
ในปีพศ 2475 เจมส์แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาเพลงอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเสี่ยงสูงทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกว่านิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอนการค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอมซึ่งคำว่ามีค่ามากกว่ามวลรวมของโปรตอนเสื้อผ้าคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วยประมวลของอะตอมมีค่า 12 หน่วยและมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกันดังนั้นอิเล็กตรอนโปรตอนและนิวตรอนจึงเป็นอนุภาคในอะตอมซึ่งอนุภาคแต่ละชนิดมีรายละเอียดดังนี้
' อิเล็กตรอน (Electron) สัญลักษณ์ e - มีแระจุลบ และมีมวลน้อยมาก
' โปรตอน สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)
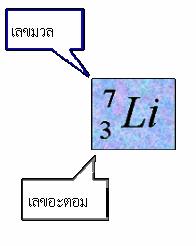
' นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอนเลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม (atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล (mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุคำศัพท์ที่ควรทราบ
ไอโซโทป ( Isotope ) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น
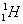
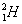
ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน เช่น
ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P < Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7
แบบจำลองอะตอมของนีลส์โบร์
จำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ระดับพลังงานจะมีค่าเท่ากับ 2n^2 เมื่อ n คือตัวเลขแสดงระดับพลังงานถ้าพิจารณาตามหลัก 2n^2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 289 และจากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของธาตุทั้งสองมีเพียง 8 อิเล็กตรอนและอิเล็กตรอนที่เพิ่มมา 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 อิเล็กตรอน
เมื่อพิจารณาข้อมูลแล้วจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอนระดับพลังงานที่ 2 มีได้มากที่สุดคือแบบอิเล็กตรอนสำหรับระดับพลังงานที่ 3 จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีมากที่สุด 18 อิเล็กตรอนด้วยคือจำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ระดับพลังงานจะมีค่าเท่ากับ 2n^2 เมื่อ n คือตัวเลขแสดงระดับพลังงานถ้าพิจารณาตามหลัก 2n^2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 289 และจากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของธาตุทั้งสองมีเพียง 8 อิเล็กตรอนและอิเล็กตรอนที่เพิ่มมา 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 อิเล็กตรอน
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
นักเรียนทราบมาแล้วว่าโบเสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากันโดยความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้นการอธิบายเกี่ยวกับเส้นสเปกตรัมของโบว์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความสนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสงออกมาและมองเห็นเป็นหนึ่งเส้นแท้จริงนั้นประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้นซึ่งนำไปสู่ข้อสรุปที่ว่าเส้นสเปกตรัมที่เกิดขึ้นนอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลักซึ่งแทนด้วย n แล้วยังเป็นการ พลังงานของอิเล็กตรอนจากระดับพลังงานย่อยของแต่ละระดับพลังงานหลักอีกด้วยนักวิทยาศาสตร์ได้กำหนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำดับระดับพลังงานที่ 1 (n = ) มี 1 ระดับพลังงานย่อยคือ s ระดับพลังงานหลักที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d และระดับพลังงานหลักที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัลอิเล็กตรอนมีการเคลื่อนที่ตลอดเวลาความหนาแน่นของกลุ่มหมอกอิเล็กตรอน ซึ่งอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกันบริเวณรอบนิวเคลียสซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออเรนทอลการศึกษา พบว่าจำนวนออร์บิทัลในแต่ละพลังงานย่อยมีค่าแตกต่างกันซึ่งสรุปได้ดังนี้ระดับพลังงานย่อย s มี 1 ออร์บิทัล ระดับพลังงานย่อย p มี 3 ออร์บิทัล ระดับพลังงานย่อยดีมี 5 ออร์บิทัล รอบพลังงานย่อย f มี 7 ออร์บิทัล
อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน การบรรจุอิเล็กตรอน ตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว ดังที่กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่ได้เป็นไปตามหลักการนั้น เช่น Cr มีเลขอะตอม 24 Cu มีเลขอะตอม 29
ธาตุที่ได้รับหรือเสียอิเล็กตรอน สามารถเขียนการจัดเรียงอิเล็กตรอนได้ดังนี้ 1.กรณีที่ถ้าได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว 2.กรณีที่ถ้าเสียอิเล็กตรอนให้บรรจุอิเล็กตรอน ตามปกติก่อนจากนั้นจึงนำอิเล็กตรอนที่อยู่ชั้นนอกสุดออก2.4 ตารางธาตุและสมบัติของธาตุหมู่หลักปัจจุบันนักวิทยาศาสตร์ได้ค้นพบธาตุแล้วเป็นจำนวนมากถ้าเรานั้นอาจมีสมบัติบางประการคล้ายกัน และบางประการแตกต่างกันจึงยากที่จะจดจำสมบัติต่างๆของแต่ละธาตุได้ทั้งหมดนักวิทยาศาสตร์จึงหาเกณฑ์ในการจัดธาตุที่มีสมบัติคล้ายการให้อยู่ในกลุ่มเดียวกันเพื่อง่ายต่อการศึกษา2.4.1 วิวัฒนาการของตารางธาตุเมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุเหล่านี้แล้วเราวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดตารางธาตุเป็นกลุ่มได้หลายแบบในปีพศ. 2360 โยฮันน์เดอเบอไรเนอร์ เต้นนักเคมีคนแรกที่พยายามจัดตารางธาตุเป็นกลุ่มกลุ่มกลุ่มละ 3 ช่าตอนสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม โดยพบว่าท่าทางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีก 2 ธาตุที่เหลือ ดังรูปในปี พ. ศ. 2427 จอห์นนิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียนต่างชาติหมดอะตอมจากน้อยไปมากพบว่าถ้าที่ 8 จะมีสมบัติเหมือนท่าที่หนึ่งเสมอ โดยไม่รวมค่าไฮโดรเจนและแก๊สมีสกุล การจัดเรียงธาตุตามแนวคิดของนิวตันใช้ได้ถึงธาตุแคลเซียมเท่านั้นกดนี้ไม่สามารถอธิบายได้เพราะว่า เหตุใดมวลอะตอมจึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุทำให้ไม่เป็นที่ยอมรับในเวลาต่อมา ดังรูปในปี พ.ศ. 2412 ยูลิอุส โลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมันและ ดิมิทรี เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซียศึกษารายละเอียด ของทอดต่างๆมากขึ้นทำให้มีข้อสังเกตว่าถ้าท่านเองตามมวลอะตอมจากน้อยไปมากจะพบว่าท่านมีสมบัติคล้ายกันเป็นช่วงช่วงการที่ธาตุต่างๆมีสมบัติคล้ายกันเป็นช่วงช่วงเช่นนี้ จึงต้องเป็นกรดเรียกว่ากฎพิริออดิก การจัดธาตุเป็นหมวดหมู่ของเมนเดเลเอฟ ไม่ได้หยุดการเรียงลำดับตามมวลอะตอมจากน้อยไปมากเพียงอย่างเดียวแต่ได้นำสมบัติที่คล้ายคลึงกันของธาตุที่ปรากฏซ้ำกันเป็นช่วงๆมาพิจารณาด้วยนอกจากนี้ยังได้เว้นช่องว่างไว้โดยคิดว่าน่าจะเป็นตำแหน่งของธาตุที่ยังไม่ได้มีการค้นพบโดยที่ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์ กับสมบัติของธาตุเมนเดเลเอฟ จึงได้ทำนายสมบัติของธาตุ ที่ยังไม่ได้มีการค้นพบ 3 ธาตุและให้ชื่อว่า เอคา-โบรอน เอคา-อะลูมิเนียม และ เอคา-ซิลิกอน ในเวลาต่อมา ก็ได้ค้นพบธาตุสแกนเดียม แกลเลียม และเจอร์เมเนียมตามลำดับ ซึ่งสมบัติใกล้เคียงกับที่ได้ทำนายไว้ในปีพ. ศ. 2456 เฮนรี โมสลีย์ นักวิทยาศาสตร์ชาวอังกฤษ เสนอให้จัด ธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่างๆของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุในปัจจุบันจึงได้ปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามเลขอะตอมจากน้อยไปมาก ดังรูปแบ่งธาตุในแนวตั้งเป็น 18 แถวโดยเรียกแถวในแนวตั้งว่าหมู่และแบ่งธาตุในแนวนอนเป็น 7 แถวโดยเรียกแถวในแนวนอนว่าคาบ2.4.2 กลุ่มของธาตุในตารางธาตุการที่นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของธาตุต่างๆถ้าแบ่งกลุ่มของธาตุตามสมบัติความเป็นโลหะจะแบ่งได้ 3 กลุ่มคือธาตุโลหะเป็นธาตุที่นำไฟฟ้าและความร้อนได้ดีธาตุกึ่งโลหะเป็นธาตุที่นำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้องจะจะนำไฟฟ้าได้ดีเมื่ออุณหภูมิสูงขึ้นและธาตุอโลหะซึ่งเป็นธาตุที่ไม่นำไฟฟ้าเลยยกเว้นคาร์บอนและฟอสฟอรัสดำเมื่อพิจารณาตำแหน่งของธาตุพบว่าธาตุโลหะอยู่ทางซ้ายมือของตารางธาตุ ธาตุอโลหะจะอยู่บริเวณที่เป็นขั้นบันไดและธาตุอโลหะจะอยู่ขวามือของตารางธาตุยกเว้นไฮโดรเจนอยู่ทางซ้ายมือของตารางธาตุถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอน ในออร์บิทัล s p d f ที่มีพลังงานสูงสุด และมีอิเล็กตรอนบรรจุอยู่จะแบ่งธาตุได้เป็น 4 กลุ่มใหญ่คือถ้ากลุ่ม s ได้แก่ธาตุในหมู่ที่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ธาตุในหมู่ที่ 13 ถึง 18 ยกเว้นฮีเลียมธาตุกลุ่มดีได้แก่ธาตุในหมู่ที่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่นิยมมาจากหมู่ 3 คาบที่ 6 และ 7ธาตุกลุ่ม s และธาตุกลุ่ม p เรียกรวมกันว่า ถ้ากลุ่ม a ซึ่งเป็นกลุ่มของธาตุเรพรีเซนเททีฟ หรืออาจเรียก กลุ่มธาตุหมู่หลัก เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่มเอพบว่าถ้าในแนวตั้งที่อยู่ในกลุ่มเอจะมีเวเลนซ์อิเล็กตรอนและจำนวนเวเลนซ์อิเล็กตรอน เท่ากัน จะตรงกับเลขหมู่ธาตุบางหมู่มีการกำหนดชื่อที่เป็นสากลเช่น 5 หมู่ IA มีชื่อเรียกว่าโลหะแอลคาไล ธาตุหมู่ IIA มีชื่อเรียกว่าโลหะแอลคาไลน์เอิร์ท ธาตุหมู่ VIIA มีชื่อเรียกว่า ธาตุแฮโลเจน และธาตุหมู่ VIIIA ยกเว้น Og เรียกว่าแก๊สมีสกุล กลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือกลุ่มแทรนซิชัน ซึ่งแบ่งเป็นทรานซิชันชั้นนอกและธาตุแทรนซิชันชั้นในได้แก่กลุ่ม d และ f ตามลำดับ ยังสามารถแบ่งได้เป็น 2 กลุ่มย่อยกลุ่มได้อยู่คาบที่ 6 และมีเลขอะตอมตั้งแต่ 57 ถึง 71 เมื่อกลุ่มนี้ว่าแลนทานอยด์ กลุ่มที่ 2 อยู่คาบที่ 7 และมีเลขอะตอมตั้งแต่ 89 ถึง 130 กลุ่มนี้ว่ากลุ่มธาตุแอกทินอยด์ เมื่อพิจารณา การจัดเรียงอิเล็กตรอนของธาตุแทรนซิชันพบว่าจำนวนเวเลนซ์อิเล็กตรอนส่วนใหญ่เท่ากับ 2 เมื่อพิจารณาธาตุกลุ่มนี้ตามแนวนอนพบว่าจำนวนระดับพลังงานจะตรงกับเลขที่คาบเช่นเดียวกับธาตุในกลุ่มธาตุหมู่หลัก จากการศึกษาการจัดเรียงธาตุในตารางธาตุช่วยให้ทราบถึงตารางธาตุในปัจจุบันจัดธาตุเป็นหมู่และคาบโดยอาศัยสมบัติบางประการที่คล้ายกันสมบัติของธาตุหมู่หลักตามหมู่และตามคาบซึ่งได้แก่ขนาดอะตอม รัศมีไอออน พลังงานไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพันธภาพอิเล็กตรอน
2.4.3 ขนาดอะตอม
ตามแบบจำลองอะตอมแบบกลุ่มหมอกอิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดียวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันถึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในสภาวะอิสระหรือเป็นอะตอมเดี่ยวในทางปฏิบัติจึงบอกขนาดอะตอมด้วยรัศมีอะตอมซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะทางระหว่างนิวเคลียสของอะตอมทั้ง 2 ที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน เพื่อศึกษา รัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ดังรูป
เมื่อพิจารณาขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันพบว่า ขนาดอะตอมมีแนวโน้มลดลงหมายเลขอะตอมเพิ่มขึ้นอธิบายได้ว่าเนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกันแต่มีจำนวนโปรตอนในนิวเคลียสต่างกันเท่าที่มีจำนวนโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนด้วยอะไรที่มากกว่าธาตุที่มีจำนวนโปรตอนน้อยเวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่าทำให้อิเล็กตรอนมีขนาดเล็กลงส่วนธาตุในหมู่เดียวกันเมื่อใดอะตอมเพิ่มขึ้นจำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีต่ออีก 1 ตอนเพิ่มขึ้นด้วยอิเล็กตรอนที่อยู่ในชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอนทำให้แรงดึงดูดต่อ เวเลนซ์อิเล็กตรอน มีน้อยเป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอนเมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออนการบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดของอะตอม กล่าวคือ จะบอกเป็นค่ารัศมีไอออนซึ่งพิจารณาจากระยะทางระหว่างนิวเคลียสของไอออนคู่หนึ่งหนึ่งที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
เมื่อโลหะ ทำปฏิกิริยากับอโลหะอะตอมของโลหะจะเสียเวลาแต่เล็กจนกลายเป็นไอออนบวกจำนวนอิเล็กตรอนในอะตอมจึงลดลงทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วยหรือกล่าวอีกนัยหนึ่งก็คือแรงดึงดูดระหว่าง ประจุในนิวเคลียสกับอิเล็กตรอนจากเพิ่มมากขึ้น Iron ห่วงจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบเนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิมไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม ดังรูป2.4.5 พลังงานไอออไนเซชัน
พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชัน โดยค่า IE แสดงถึงความยากง่ายในการทำให้ อะตอมในสถานะแก๊สกลายเป็นไอออนบวก โดยอีน้อยแสดงว่าทำให้เป็นไอออนบวกได้ง่ายแต่ถ้า IE มากแสดงว่าทำให้เป็นไอออนบวกได้ยากก็ทำให้ไฮโดรเจนอะตอมในสถานะแก๊สกลายเป็นไรโดยเช่นไอออนและสถานะแก๊สเขียนได้ดังนี้H(g) ----> H^+(g) + e^-
การทำให้อิเล็กตรอนหลุดออกจากอะตอมของไฮโดรเจนจะต้องใช้พลังงานอย่างน้อยที่สุด 1318 กิโลจูลต่อโมล นั่นคือ พลังงานไอออไนเซชันของไฮโดรเจนอะตอมเท่ากับ 1318 กิโลจูลต่อโมล ธาตุไฮโดรเจน มี 1 อิเล็กตรอนจึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียวถ้าธาตุที่มีหลายอิเล็กตรอน ก็จะมีพลังงานไอออไนเซชันหลายค่าพลังงานที่น้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกมาจากอะตอม ที่อยู่ในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 เขียนย่อเป็น IE 1 พลังงานที่ทำให้อิเล็กตรอนในลำดับต่อๆมาหลุดออกมาจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 2 3 ... และเขียนย่อเป็น IE 2 IE 3 ตามลำดับ
2.4.6 สัมพรรคภาพอิเล็กตรอนพลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ดังนี้A(g) + e^- ---> A^-(g)หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก2.4.7 อิเล็กโทรเนกาติวิตีอิเล็กโทรเนกาติวิตีความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางเป็นดังนี้เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
2. http://thn25564chemisty.blogspot.com/p/2.htmlที่มา: 1. https://sites.google.com









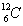
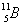










ไม่มีความคิดเห็น:
แสดงความคิดเห็น